Lieblinge der Pharmabranche
Einst machten Pharmahersteller einen Bogen um die Entwicklung von Präparaten gegen seltene Krankheiten (Orphan Drugs). Doch inzwischen nutzen Pharmafirmen die Regelungen aus, um Toppreise zu erzielen. Von Melanie Schröder und Dr. Carsten Telschow
Orphan Drugs haben sich
vom Stief- zum Lieblingskind der Pharmaindustrie gemausert. Seit 2014 ist ungefähr jedes dritte, neu auf den Markt gebrachte Medikament für die Behandlung einer seltenen Krankheit. Dies belegt der neue Arzneiverordnungs-Report. Noch in den 1990er Jahren vernachlässigte die Pharmabranche die Entwicklung von Orphan Drugs. Die zu erwartenden Umsätze schienen wegen der geringen Zahl der zu behandelnden Patienten nicht attraktiv genug zu sein. Dies änderte sich mit dem neuen Jahrtausend. Ein Grund dafür: Die Europäische Union (EU) schuf 2001 Anreize für deren Forschung und Entwicklung. Neben kostenfreier wissenschaftlicher Beratung, der Reduktion oder gänzlichen Erlassung von Zulassungsgebühren sowie direkter Forschungsförderung erhielten die Hersteller eine Marktexklusivität für zehn Jahre und weitere zwei Jahre bei Arzneimitteln für Kinder mit seltenen Erkrankungen. In Deutschland gibt es zudem Erleichterungen bei der frühen Nutzenbewertung: Durch die Zulassung gelten Nutzen und Zusatznutzen als nachgewiesen.
Überdurchschnittlich teuer.
Seit 2001 ist die Zahl der zugelassenen Orphan Drugs gestiegen. Folglich nehmen auch deren Gesamtumsätze zu. Während 2007 ihr Anteil am Gesamtumsatz aller Arzneimittel bei rund zwei Prozent lag, hat er sich auf acht Prozent vervierfacht, wie der neue Arzneiverordnungs-Report ausweist. Der Umsatz der Orphan Drugs lag 2017 bei 3,3 Milliarden Euro. Ihr Anteil machte mit 1,1 Millionen Verordnungen aber nur 0,2 Prozent am Gesamtverordnungsvolumen aus. Der Anstieg lässt sich nicht über einen Mengeneffekt erklären, sondern hat seine Ursache in den hohen Preisen. So sind die durchschnittlichen Kosten für Orphan Drugs 23 Mal höher als die für „normale“ patentierte Präparate und liegen 195 Mal über dem Durchschnittspreis anderer Medikamente.
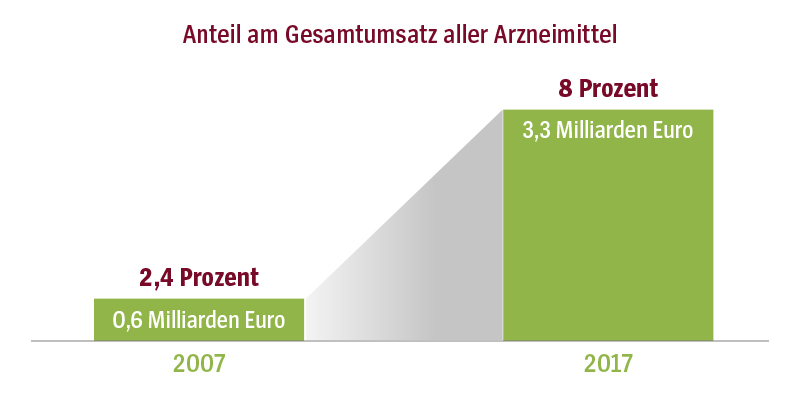
Aktuelle Zahlen belegen: Der Anteil der Medikamente für die Behandlung seltener Erkrankungen (Orphan Drugs) am Gesamtumsatz aller Arzneimittel hat sich innerhalb von zehn Jahren fast vervierfacht. Im Jahr 2007 lag ihr Umsatz bei 0,6 Milliarden Euro. Das entsprach einem Anteil von 2,4 Prozent am Gesamtumsatz aller Arzneimittel (25,3 Milliarden Euro). 2017 machte er mit rund drei Milliarden Euro acht Prozent aus (Umsatz aller Präparate 2017: 41,4 Milliarden Euro).
Quelle: Arzneiverordnungs-Report 2018
Indikationen ausgeweitet.
Nur mit höheren Preisen, so argumentieren die Pharmahersteller, können die Forschungs- und Entwicklungskosten für Orphan Drugs aufgrund weniger Patienten erwirtschaftet werden. Gleichzeitig aber sind bei immer mehr Orphan Drugs die Indikationen ausgeweitet worden.
Ein Paradebeispiel hierfür ist Glivec®. Das Präparat wurde erstmals im Jahr 2001 für die Behandlung der chronischen myeloischen Leukämie, einer seltenen Form von Blutkrebs, zugelassen. Mittlerweile ist es bei acht weiteren Indikationen einsetzbar – die meisten davon sind seltene Erkrankungen. Glivec® hat sich zu einem Blockbuster entwickelt und gehört zu den umsatzstärksten Arzneimitteln. Auch wenn dieses Präparat inzwischen keinen Orphan-Drug-Status mehr besitzt, ist der Pharmahersteller in den Genuss der Vorteile gekommen.
Marktmacht sorgt für Preissprünge.
Somit stellt sich die Frage, ob die hohen Preise der Orphan Drugs immer gerechtfertigt sind. Sie kosten Pharmafirmen gerade in der letzten Phase der Entwicklung (Phase III: große Patientenstudien mit bis zu 10.000 Menschen) im Schnitt rund 50 Prozent weniger als „herkömmliche“ Medikamente. Ein Grund: Die Zulassungsbehörden akzeptieren bei Orphan Drugs erheblich einfachere Studien. Zudem sorgt die beschleunigte Zulassung dafür, dass solche Präparate im Schnitt anderthalb Jahre früher als andere auf den Markt gebracht werden können. Dadurch lässt sich der Patentschutz länger für die exklusive Vermarktung nutzen. Auch profitieren Orphan-Drug-Hersteller davon, dass sie eine besonders große Marktmacht haben. Denn ist ihr Medikament gegen seltene Leiden zugelassen, erhält es in der EU eine zehnjährige Marktexklusivität, die unabhängig vom Patentschutz gilt und noch weitergehend vor Konkurrenz schützt.
Diese Marktmacht zeigt sich auch in Preissprüngen, wenn ein altbekannter Wirkstoff als Orphan Drug neu zugelassen wird. Ein Beispiel dafür ist der vor Jahren vom Markt genommene Wirkstoff Chenodesoxycholsäure, der bis 2010 unter dem Namen Chenofalk® zur Auflösung von Gallenblasensteinen imHandel war. Damals kostete das Präparat 58 Euro. 2017 brachte die Firma Leadiant den Wirkstoff als neues Arzneimittel gegen eine seltene angeborene Störung der primären Gallensäuresynthese auf den Markt. Der neue Preis: 27.513 Euro – ein Sprung von sage und schreibe 473.000 Prozent für die Nachnutzung eines altbekannten Arzneimittels. Dies ist wohl kaum durch hohe Entwicklungskosten zu erklären.

Lesetipp
Schwabe, U./Paffrath, D./Ludwig, W.-D./Klauber, J.: Arzneiverordnungs-Report 2018. 921 Seiten. 59,99 Euro. Springer-Verlag, Heidelberg.
Häufige Leiden in seltene unterteilt.
Zugleich stellt sich bei neuen Orphan Drugs die Frage, ob ihr Anwendungsgebiet tatsächlich eine seltene Erkrankung ist. In der EU gilt ein Leiden dann als selten, wenn nicht mehr als fünf von 10.000 Menschen davon betroffen sind. Erkrankungen lassen sich aber auch als selten definieren, wenn anhand spezieller, beispielsweise genetisch bedingter Merkmale eine Krankheit in Subgruppen unterteilt wird. Gerade die Onkologie stellt ein attraktives und ergiebiges Feld dar, um durch eine Aufteilung von Tumorerkrankungen in viele kleine Untergruppen seltene Erkrankungen zu „kreieren“, um dann für einzelne davon ein Medikament zu entwickeln. Beispielhaft dafür sind die Proteinkinase-Inhibitoren. Proteinkinasen sind Enzyme, die Prozesse im Körper steuern. Diese können bei Krebs außer Kontrolle geraten. Proteinkinase-Inhibitoren hemmen den Prozess und können das Krebswachstum stoppen.
Oftmals kommen Präparate in den Genuss einer Förderung, die für sie gar nicht beabsichtigt war. Sie sind für eine kleine Subgruppe von Patienten mit speziellen Eigenschaften zugelassen, obwohl die Krankheit an sich sehr viel mehr Patienten umfasst. Eigentlich zielen die von der Europäischen Union und vom deutschen Gesetzgeber geschaffenen Förderanreize auf die Entwicklung von Medikamenten gegen „echte“ seltene Leiden und sind nicht für eine individualisierte Medizin gedacht, die sich vermutlich auch unabhängig von diesen Anreizen erfolgreich entwickelt hätte.
Exklusive Marktstellung begrenzen.
Um (zu) hohe Preise zu verhindern, ist in erster Linie die Preissetzungsmacht der Pharmaunternehmen zu reduzieren. Ein Wegfall oder eine Absenkung der zehnjährigen Marktexklusivität – in den USA beträgt sie beispielsweise nur sieben Jahre, in anderen Ländern existiert sie überhaupt nicht – würde die Marktmacht eindämmen und könnte folglich zu geringeren Preisen führen. Zudem sollten bei deutschen Preisverhandlungen mit den Herstellern, die sich an die frühe Nutzenbewertung anschließen, grundsätzlich Preis-Mengen-Vereinbarungen getroffen werden, die bei Ausweitung der Patientenzahl eine deutliche Absenkung des Erstattungsbetrags nach sich ziehen können, ohne dass zunächst die Ergebnisse neuer Bewertungsverfahren abgewartet werden müssen.
Präparate gegen seltene Leiden haben nicht per se einen Zusatznutzen.
Vollständige Nutzenbewertung sinnvoll.
Auch ist zu hinterfragen, warum Orphan Drugs automatisch einen Zusatznutzen zuerkannt bekommen. Diese Regelung könnte auf solche Arzneimittel begrenzt werden, für die tatsächlich keinerlei therapeutische Alternative besteht. Von sieben Präparaten, die nach Überschreiten der Umsatzgrenze von 50 Millionen Euro, ab der (Zusatz-)Nutzennachweise erfolgen müssen, oder nach dem Aufheben des Orphan-Drug-Status eine reguläre Nutzenbewertung durchlaufen haben, war bei fünf von 13 Patientengruppen kein Zusatznutzen feststellbar. Dies zeigt, dass auch für Orphan Drugs die vollständige Nutzenbewertung ab Markteintritt sinnvoll ist. Dadurch ließe sich auch die Preissetzungsmacht eines Herstellers eindämmen. Zugleich wäre es fair gegenüber Herstellern anderer neuer Arzneimittel, die ihr Präparat einer frühen Nutzenbewertung unterziehen müssen, gegenüber den Krankenkassen, die die Beitragsgelder wirtschaftlich einsetzen müssen, sowie gegenüber den Patienten, die einen Anspruch auf eine unabhängige Einordnung des Stellenwerts eines Medikaments haben.
Kriterien für Orphan Drugs überdenken.
Eine große Herausforderung sind auch geeignete Kriterien, mit denen sich „echte“ seltene Erkrankungen von Krankheiten abgrenzen lassen, die sich durch Forschung und Weiterentwicklung der (individualisierten) Medizin ergeben. Angesichts der Marktdynamik im Segment der Orphan Drugs muss sich die Europäische Arzneimittel-Agentur EMA dieser Frage widmen und die Voraussetzungen für die Anerkennung eines Medikaments als Orphan Drug schärfen.