Resistenzen ohne Grenzen
Antibiotika haben gefährlichen Infektionen den Schrecken genommen. Aber Keime entwickeln vermehrt Resistenzen gegen die Mittel. Um ein Versagen der medizinischen Wunderwaffe zu verhindern, sind Konzepte für globale Gesundheitsstrategien gefragt, macht Entwicklungsexperte Prof. Dr. Dr. Jens Holst in seiner Analyse deutlich.
Aus der Medizin sind sie nicht mehr wegzudenken. Sie erlauben die ursächliche und wirksame Therapie von Infektionen und tragen maßgeblich dazu bei, dass die Menschen ehemals tödliche Krankheiten wie Lungenentzündungen und Blutvergiftungen überleben. Seit über 75 Jahren kommen antibiotisch wirksame Substanzen in der Medizin regelmäßig bei der Behandlung von Infektionen zum Einsatz. Auch wenn dazu im Prinzip alle Medikamente gehören, die gegen Bakterien, Pilze, Viren oder Parasiten wirksam sind, bezeichnet man üblicherweise vor allem die Wirkstoffe als Antibiotika, die gegen Bakterien wirken. Diese können Mikroben auf zwei verschiedene Arten schädigen: Entweder zerstören sie die Zellwand der Bakterien oder sie verhindern die Zellvermehrung beziehungsweise unterbinden lebenswichtige Stoffwechselprozesse der Bakterienzelle.
Allerdings sind Krankheitserreger immer häufiger unempfindlich gegenüber verfügbaren Antibiotika, manche sogar gegenüber allen gängigen Wirkstoffen. Antibiotikaresistenzen und insbesondere multiresistente Keime stellen eine Herausforderung für die medizinische Versorgung und die Gesundheit der Bevölkerung dar. Weltweit warnen Expertinnen und Experten vor der Ausbreitung von Resistenzen und deren Folgen für die Medizin. Die Weltgesundheitsorganisation (WHO) spricht bereits von einer „postantibiotischen Ära“, in der einfache Infektionen wieder zur tödlichen Gefahr werden könnten. Seit 2015 überwacht sie kontinuierlich die Resistenzentwicklung bei bestimmten Bakterien in verschiedenen Weltregionen und fördert die Erforschung neuer Antibiotika.
Die Behörden in den USA und Großbritannien haben mittlerweile Warnungen vor Antibiotika-Resistenzen herausgegeben. Als gemeinsame Initiative der Ministerien für Gesundheit, Ernährung und Landwirtschaft sowie Bildung und Forschung beschloss die Bundesregierung 2015 die Deutsche Antibiotikaresistenzstrategie (DART 2020, siehe Lese- und Webtipps). Ein mehrgleisiges Vorgehen und verlässliche Daten über Antibiotikaverbrauch und -resistenzen sollen zur Begrenzung des Problems beitragen.
Bakterien werden unempfindlich.
Die Resistenz, also die Unempfindlichkeit von Erregern gegenüber schädlichen Substanzen, entsteht in einem natürlichen Evolutionsprozess – und das seit langer Zeit. So wiesen Bakterien, die man in 30.000 Jahre alten Proben aus Dauerfrostböden in Alaska isolierte, Gene für die Unempfindlichkeit gegenüber gängigen Antibiotika wie Penicillin, Tetrazykline und Vancomycin auf. Selbst in unbewohnten Gegenden wie der Antarktis fanden Forscher Keime, die widerstandsfähig gegen übliche Antibiotika waren.
Resistenzen entstehen, wenn Bakterien und Mikroorganismen extremen Umweltbedingungen ausgesetzt sind oder sich gegen feindliche Lebewesen und Giftstoffe verteidigen müssen. So können zum Beispiel Pilze Antibiotika produzieren, um sich gegen Bakterien zur Wehr zu setzen. Dies nutzte der als Entdecker moderner Antibiotika geltende britische Arzt Alexander Fleming, als er aus dem Schimmelpilz Penicillium eine Substanz isolierte, die die Zellwandsynthese der Bakterien hemmt. So entstand das erste medizinisch einsetzbare Antibiotikum Penicillin, und so ist auch zu erklären, dass es schon bei dessen Einführung resistente Bakterien gab, die Penicillin spalten konnten.
- Bericht über den Antibiotikaverbrauch und die Verbreitung von Antibiotikaresistenzen in der Human- und Veterinärmedizin in Deutschland
- Helmut Schröder: Hände weg von der eisernen Reserve. In: G+G 7-8/2011, S. 20–27
- Bundesgesundheitsministerium: DART 2020 - Deutsche Antibiotika-Resistenzstrategie
- In dieser Ausgabe: „Hygienepersonal reicht nicht“ – Prof. Dr. med. Winfried Kern im Interview über den sachgemäßen Einsatz von Antibiotika in Kliniken und Arztpraxen
Mikroorganismen reproduzieren sich alle 20 bis 30 Minuten durch Zellteilung. Dabei entstehen immer wieder kleine Fehler im Erbgut, sogenannte Mutationen. Aufgrund der schnellen Vermehrung von Bakterien können solche Mutationen dazu führen, dass ein ganzer Bakterienstamm rasch widerstandsfähig gegenüber Umweltgiften oder eben auch bestimmten Antibiotika wird. Denn während alle anderen Keime noch empfindlich gegenüber der toxischen Substanz sind und absterben, überleben die resistenten Erreger und geben ihre Widerstandsfähigkeit an die nachfolgenden Generationen weiter. Da Bakterien außerdem genetisches Material untereinander austauschen, können sie die Resistenzen an andere Bakterienarten weitergeben.
Der Mensch hat den Resistenzdruck erhöht.
In den letzten Jahren hat die Resistenzentwicklung dramatisch zugenommen. Anfangs waren multiresistente Keime vorwiegend aus Krankenhäusern und Pflegeeinrichtungen bekannt. Aber auch in Rinder-, Schweine-, Hühner- und Putenfleisch finden sich heute oftmals Salmonellen und andere Erreger, die gegen verschiedene Antibiotika unempfindlich sind. Mittlerweile sind mehrfach resistente Mikroorganismen auch in Bächen, Flüssen und Badeseen nachweisbar. Wo immer es Bakterien gibt, ist von Multiresistenzen auszugehen.
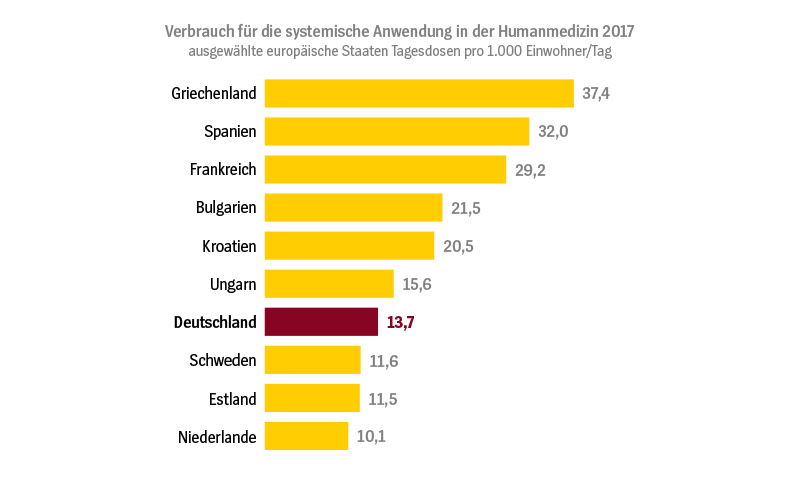
Mit 13,7 Tagesdosen pro 1.000 Einwohner und Tag lag Deutschland im Jahr 2017 beim Antibiotikaverbrauch europaweit im unteren Drittel. Zu den Spitzenreitern gehören Griechenland und Spanien mit mehr als doppelt so hohen Tagesdosen pro 1.000 Einwohnern. Vergleichsweise niedrige Verbrauchszahlen weisen die Niederlande und Estland auf.
Quelle: ESAC-Net
Verantwortlich für die zuletzt starke und rasche Zunahme der Resistenzentwicklung ist in erster Linie der Mensch. Die weit verbreitete, lange Jahre zunehmende Verwendung antibiotischer Substanzen in der Humanmedizin und in der Landwirtschaft hat den Resistenzdruck auf die Bakterien massiv erhöht.
„Der vielfach ungerechtfertigte Einsatz von Antibiotika in der Medizin ist eine wesentliche Ursache für die bedrohliche Resistenzentwicklung“, erklärt der leitende Hygieniker der kommunalen Kliniken in München, Dr. Gerhard Schwarzkopf, „denn fast jeder dritte Einsatz von Antibiotika ist medizinisch unangemessen.“ Das liege nicht nur an häufiger Selbstmedikation oder Unter- und Fehldosierung, sondern auch am unspezifischen Gebrauch und an falschen Indikationsstellungen: Obwohl 85 Prozent aller Infekte der oberen Atemwege durch Viren verursacht sind, verordnen Ärzte häufig antibakterielle Substanzen.
In der ambulanten Versorgung geht der Antibiotika-Einsatz bei Kindern zwar etwas zurück, dafür steigt er aber bei Erwachsenen. Das liegt auch daran, dass die Vergütung niedergelassener Ärzte von der Zahl der Patienten abhängt, die sie pro Quartal sehen, nicht aber von der Zeit, die sie sich für jeden Einzelnen nehmen. Dies begünstigt eher eine schnelle Antibiotika-Verordnung als ausführliche Patientenaufklärung und Kontrolluntersuchungen. Auch in Kliniken ist die Verwendung von Antibiotika gestiegen, obwohl sich die Häufigkeit der dort erworbenen Infektionen in den letzten 25 Jahren gar nicht verändert hat, berichtet Schwarzkopf. Der Einsatz unspezifischer Breitbandantibiotika bei schwerkranken Patienten kann zwar günstigenfalls zur erfolgreichen Bekämpfung der Erreger und zur Genesung beitragen, fördere aber die bakterielle Resistenzentwicklung.
Ärmere Länder stehen vor vielfältigen Problemen.
Schwerwiegender und komplexer als hierzulande sind die Herausforderungen in den Entwicklungs- und Schwellenländern. Das dortige Nebeneinander ausgefeilter medizinischer Versorgungssysteme für die Oberschicht und einer rudimentären, vielfach auf Selbstzahlungen beruhenden Versorgung für die Bevölkerungsmehrheit begünstigt die Resistenzentwicklung gleich doppelt.
Stimmen Sie jetzt ab
Müssen Antibiotika vorsichtiger eingesetzt werden?
Im Privatsektor erleichtert ein unkontrolliertes Verschreibungsverhalten, das vielfach eher pekuniären Interessen als strenger Indikation folgt, die Entstehung von Multiresistenzen. Und die vielen ärmeren Patienten können sich keine vollständige Antibiotika-Behandlung leisten, da sie nicht genug Geld und keine soziale Absicherung im Krankheitsfall haben und Arzneimittel in öffentlichen Gesundheitseinrichtungen häufig fehlen. Teils aggressive und irreführende Arzneimittelwerbung, halb- oder illegale Geschäfte mit Medikamenten, gefälschte Arzneien mit unzureichender Wirkstoffmenge, umweltgefährdende Herstellung und fehlende Kontrollen fördern zusätzlich die unsachgemäße Verwendung und Verbreitung von Antibiotika und damit die Entstehung von Resistenzen.
Nutztiere bekommen tonnenweise Medikamente.
Weitaus größere Mengen Antibiotika als in der Humanmedizin kommen in der Landwirtschaft zum Einsatz. Zwar sank der Verbrauch in Deutschland in den letzten Jahren stetig auf zuletzt 741 Tonnen pro Jahr. Weltweit verfüttern Tierzüchter und Tierärzte aber jedes Jahr nach Angaben internationaler Forscher die gigantische Menge von über 130.000 Tonnen; bis 2030 erwarten sie einen weiteren Anstieg auf 200.000 Tonnen.
In der Tierzucht kommen Antibiotika nicht nur bei der Behandlung erkrankter Tiere zum Einsatz, sondern auch zur Krankheitsvorbeugung. Auf schnelle Gewichtszunahme getrimmtes, vielfach in extremer Enge gehaltenes Mastvieh ist anfällig gegenüber Infektionen. Herdenbehandlung, also die antibiotische Therapie ganzer Ställe bei Erkrankung einzelner Tiere, das Dispensierrecht der Veterinärmediziner, das sie zu Arzt und Apotheker in einer Person macht, und die gering dosierte Anwendung von Antibiotika als Mastbeschleuniger – in der Europäischen Union seit 2006 verboten – tragen erheblich zur Entstehung multiresistenter Keime bei. Dabei konstatiert der Wissenschaftliche Beirat des Bundesministeriums für Ernährung und Landwirtschaft „erhebliches Potenzial zur Reduktion des Antibiotikaeinsatzes beim Masthuhn ohne Einbußen bei der Tiergesundheit“.
Der globale Transport von Gütern trägt erheblich zur Verbreitung von Antibiotika-Resistenzen bei.
Auch in der Fischzucht kommen Antibiotika in großem Umfang zum Einsatz. So errechneten Wissenschaftler der Universität Puerto Montt bereits vor 15 Jahren einen Antibiotika-Verbrauch in der südchilenischen Lachszucht von jährlich 40 bis 90 Tonnen. Bevorzugte Präparate waren Gyrasehemmer beziehungsweise Chinolone, die sich damals erst allmählich in der Humanmedizin des südamerikanischen Landes durchsetzten.
Auch Gemüse und Obst sind mit resistenten Keimen belastet, da Antibiotika wie Streptomycin und Tetrazykline auf den Plantagen zur Vorbeugung von Bakterien- und Pilzbefall zum Einsatz kommen. Beschäftigte in der Landwirtschaft sind in besonderem Maße durch die Antibiotikabelastung gefährdet. Häufig sind sie Träger multiresistenter Erreger – Krankenhäuser in den Niederlanden behandeln Schweinehalter automatisch als Risikogruppe.
Resistente Keime verursachen hohe Kosten.
Aber nicht nur Konsumenten von Produkten aus Intensivtierhaltung und industrialisiertem Anbau kommen mit resistenten Keimen in Berührung. Die von Tieren ausgeschiedenen Antibiotika und ihre Abbauprodukte gelangen über die Gülledüngung landwirtschaftlich genutzter Flächen und in vielen anderen Ländern der Erde über die Bewässerung mit mangelhaft oder gar nicht geklärtem Abwasser in die Umwelt. Auf Obst- und Gemüseplantagen versprühte Antibiotika verteilen sich durch die Luft auf die Umgebung. Regelmäßiger Antibiotikaeinsatz in der Agroindustrie fördert die Resistenzentwicklung, die Ausbreitung der verantwortlichen Gene in die Umwelt und die Übertragung gefährlicher Keime auf den Menschen.
Die zunehmende Resistenzentwicklung hat erhebliche finanzielle Konsequenzen für Gesundheitssysteme und Volkswirtschaften. Ökonomen schätzen, dass Antibiotikaresistenzen bis 2050 nicht nur weltweit mehrere Millionen Todesopfer, zusätzliche Fallkosten von etwa 50.000 und insgesamt Mehrkosten von bis zu 100 Billionen Euro verursachen könnten. Bei aller Skepsis gegenüber derartigen Hochrechnungen: Patienten mit multiresistenten Keimen erfordern umfangreichere Diagnostik, längere und aufwendigere stationäre Behandlungen zumeist auf Intensivstationen sowie Mehrausgaben für Medizintechnik und Infektionsschutz. Zusätzlich sehen Experten eine spürbare Hemmung des Wirtschaftswachstums voraus, wenn sich die Resistenzlage so weiterentwickelt wie bisher.
Öffentliche Mittel für die Forschung.
Den erheblichen gesellschaftlichen Kosten zunehmender Antibiotikaresistenzen stehen eingeschränkte Renditeaussichten bei der Erforschung neuer Wirkstoffe gegenüber. Knut Ohlsen vom Institut für Molekulare Infektionsbiologie der Universität Würzburg erklärte im „Spiegel“ das Dilemma: „Je wirksamer und spezifischer ein Mittel ist, desto weniger Geld kann man damit verdienen. Der Antibiotika-Markt liefert nicht die Milliarden-Einnahmen, die sich ein Pharmakonzern oder ein Investorenkonsortium vorstellen.“ Der weitgehende Rückzug der Pharma-Branche aus der Antibiotikaforschung und -entwicklung hat eine eklatante Forschungslücke entstehen lassen.
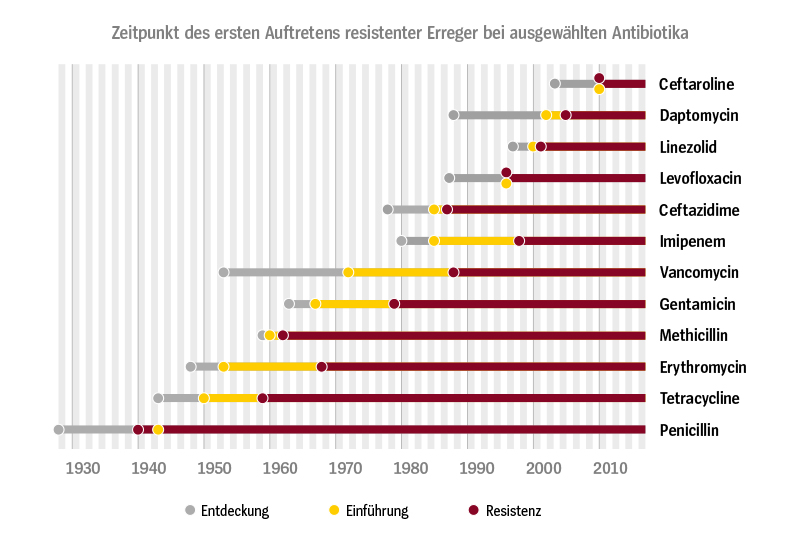
Bakterien haben gegen jedes bisher entdeckte Antibiotikum Resistenzen entwickelt. Bei Penicillin waren die ersten Erreger bereits vor der Markteinführung gegen den Wirkstoff unempfindlich. Bei Erythromycin, Vancomycin und Imipenem verstrichen hingegen rund 15 Jahre, bis die ersten gegen die Mittel resistenten Keime auftraten.
Quelle: Kupferschmidt, Kai (2016). Resistance fighters. Science 352 (6287): 758-761. DOI: 10.1126/science.352.6287.758: 759.
Hier ist die öffentliche Hand in der Pflicht. Entgegen der landläufigen Meinung tragen staatlich finanzierte Universitäten und Institute ohnehin den überwiegenden Teil der Forschung. Die Weiterentwicklung zur Marktreife und Vermarktung übernehmen dann die Pharma-Hersteller, die sich üblicherweise mit Patenten Absatz und Rendite sichern. Neue Antibiotika müssen allerdings bezahlbar sein, damit sie in ärmeren Ländern Anwendung finden.
„Gesundheitspolitisch wäre es sinnvoll, mit öffentlichen Mitteln entwickelte Medikamente vom Patentrecht auszuschließen, um die günstige Verfügbarkeit in den Mittelpunkt zu stellen“, fordert Dr. Christian Wagner-Ahlfs von der BUKO Pharma-Kampagne, der sich seit mehreren Jahren mit Fragen der Antibiotika-Resistenzentwicklung befasst. „Die besondere Herausforderung besteht darin, Reserveantibiotika so selten wie möglich einzusetzen, um eine unnötig schnelle Resistenzbildung hinauszuzögern. Diese Kombination – wenig verkaufen, aber trotzdem günstig – ist für die forschenden Pharmaunternehmen überhaupt nicht lukrativ.“
Korruption begünstigt Fehlentwicklung.
Die Ursachen der zunehmenden Antibiotikaresistenzen gehen allerdings weit über den unkritischen Einsatz antimikrobieller Wirkstoffe in der Medizin und ihre massive Verwendung in der Landwirtschaft hinaus. Auch die politischen und gesellschaftlichen Rahmenbedingungen haben erheblichen Einfluss.
Ein Vergleich der Resistenzlage in der Europäischen Union zeigte beispielsweise eine Beziehung zu schwacher öffentlicher Hand und unzureichender staatlicher Steuerung: „Je weniger ein Land die Korruption im Griff hat, desto schneller entwickeln sich Multiresistenzen gegenüber Antibiotika“, fasst eine Analyse der Deutschen Plattform für Globale Gesundheit aktuelle Forschungserkenntnisse zusammen. Demnach begünstigen die fehlende Durchsetzung von Bestimmungen, der Mangel an wirksamen Kontrollen und laxe Praktiken die Resistenzentwicklung.
Neuere Analysen bestätigen diesen Zusammenhang auch außerhalb Europas: Der Einsatz von Antibiotika in Medizin und Tierzucht stellt zwar eine relevante Ursache dar, ist aber nicht der wichtigste Treiber der Resistenzentwicklung. Viel größeren Einfluss haben mangelhafte hygienische Bedingungen, unzureichender Zugang zu sauberem Trinkwasser, fehlende öffentliche Kontrolle nicht nur im Gesundheitswesen und nicht zuletzt die Korruption.
Ein Mangel an verantwortungsvoller Regierungsführung vereitelt offenbar die erforderliche Kontrolle der Akteure in Human- und Veterinärmedizin, Pharmafirmen, Landwirtschaft, und anderswo. Die fehlende Regulierung der Antibiotika-Abgabe, irreführende Pharmawerbung und Verbreitung gefälschter Arzneimittel mit unzureichender Wirkstoffmenge machen den konsequenten, rationalen und resistenzvermeidenden Gebrauch von Antibiotika unmöglich und begünstigen vielerorts die Entstehung von Resistenzen.
Gesundheit ist nicht nur eine nationale Frage.
Wie kaum ein anderes aktuelles Thema verdeutlichen die zunehmenden Antibiotikaresistenzen die Bedeutung von Global Health, also des internationalen, weltweiten Verständnisses von Gesundheit und ihren Ursachen. Gesundheit und Wohlbefinden der Menschen machen heute weniger denn je an Ländergrenzen Halt und sind nur bedingt innerhalb einzelner Länder zu beeinflussen.
Zwar können funktionierende, allen zugängliche Gesundheitssysteme, hinreichende öffentliche Finanzierung der medizinischen Versorgung und verantwortungsvolle Führung der Staatsgeschäfte zu einem rationaleren und somit resistenzvermeidenden Gebrauch von Antibiotika beitragen und die Resistenzentwicklung bremsen. Das allein aber reicht nicht aus: Strategien gegen die Antibiotika-Resistenzentwicklung müssen über Staatsgrenzen und letztlich global wirksam werden, um erfolgreich zu sein.
Zehn-Punkte-Plan zur Vermeidung behandlungsassoziierter Infektionen und Antibiotika-Resistenzen:
- Ausbreitung multiresistenter Erreger verhindern
- Hygienestandards in allen Einrichtungen weiter ausbauen
- Bessere Informationen zur Hygienequalität in Krankenhäusern
- Meldepflichten zur Früherkennung resistenter Erreger verschärfen
- Verpflichtende Fortbildung des medizinischen Personals
- Versorgungsforschung zur Vermeidung nosokomialer Infektionen verbessern
- One-Health-Gedanken stärken: Aktualisierung der Deutschen Antibiotika-Resistenzstrategie
- Forschung und Entwicklung neuer Antibiotika ermöglichen (Pharmadialog)
- Deutsche globale Gesundheitspolitik zur Bekämpfung von Antibiotika-Resistenzen nutzen
- Antibiotika-Resistenzen durch Kooperation der G7 bekämpfen
Quelle: Bundesgesundheitsministerium
Denn Infektionen und Resistenzen beschränken sich in der globalisierten Welt von heute weniger denn je auf einzelne Länder und Regionen. Die Mobilität der Menschen aufgrund von Vertreibung, Arbeit, Familie, Freizeit und nicht zuletzt Medizintourismus hat in den letzten Jahrzehnten weltweit massiv zugenommen.
Bei Reisenden sind resistente Erreger oft monatelang nachweisbar und beeinträchtigen die körpereigene Bakterienbesiedlung. Der globale Transport von Gütern einschließlich Tieren, Tierprodukten und anderen landwirtschaftlichen Erzeugnissen trägt in erheblichem Maß zur Verbreitung von Resistenzen bei. Die internationale Wirtschafts- und Handelspolitik ist zunehmend durch globalen Wettbewerb bestimmt.
Um auf dem Weltmarkt bestehen zu können, ahmen aufstrebende Nationen herkömmliche Produktionsweisen und Vermarktungsstrategien der reichen Länder nach. Dem spürbaren Rückgang des Antibiotikaverbrauchs in Nordamerika, Europa und Japan im letzten Jahrzehnt steht ein deutlicher Anstieg insbesondere in China, aber auch in anderen Schwellenländern wie Brasilien, Russland, Indien und Vietnam gegenüber. Wenn dieser Trend anhält, wird der weltweite Antibiotikaverbrauch bis 2030 noch einmal um mehr als die Hälfte steigen.
Bundesregierung unterstützt den One-Health-Ansatz.
Angesichts dieser Entwicklung verfolgt die Bundesregierung das One-Health-Konzept, also die Kombination von Maßnahmen in Humanmedizin, Landwirtschaft, Ernährung und Umwelt.
Der „10-Punkte-Plan zur Bekämpfung resistenter Erreger“ des Bundesgesundheitsministeriums (siehe „Wie der Gesetzgeber Resistenzen bekämpfen will“) und die Deutsche Antibiotika-Resistenzstrategie benennen One Health als wichtige Voraussetzung für eine erfolgreiche Eindämmung der Resistenzentwicklung. Während der G7-Präsidentschaft im Jahr 2015 setzte Deutschland das Thema Antibiotika-Resistenzen auf die Tagesordnung der führenden Wirtschaftsnationen. In ihrer „Berliner Erklärung zur Bekämpfung von Antibiotika-Resistenzen“ setzten sich die G7-Gesundheitsminister dafür ein, Antibiotika nur gezielt zu therapeutischen Zwecken zu verwenden, andere Länder beim Kampf gegen Antibiotika-Resistenzen zu unterstützen und die Forschung und Entwicklung neuer Antibiotika zu fördern. Zwei Jahre später nutzte die Bundesregierung die deutsche G20-Präsidentschaft, neben der gezielten Forschungsförderung den One-Health-Ansatz auf internationaler Ebene zu stärken.
Die weltweite Resistenzentwicklung ist ein wichtiges Thema in dem neu eingerichteten Studiengang „International Health Sciences“ (IHS) an der Hochschule Fulda.
Seit dem Wintersemester 2018/19 bietet das erste internationale Bachelor-Programm am Fachbereich Pflege und Gesundheit jungen Menschen eine grundständige Ausbildung zu Gesundheitswissenschaftlern mit globaler Perspektive.
„Wir erwarten, dass wir mit diesem grundständigen Studiengang IHS eine Lücke in der deutschen Hochschullandschaft schließen und die Zahl global tätiger Gesundheitswissenschaftler aus Deutschland steigern können“, so Studiengangsleiter Professor Dr. Dr. Jens Holst.
Die allenfalls laue Unterstützung durch die G20-Landwirtschaftsminister lässt allerdings Zweifel an der Wirksamkeit solcher Erklärungen aufkommen. Mehr noch: So wichtig und richtig der One-Health-Ansatz ist – letztlich bleibt er unzureichend.
Die Folgen des Klimawandels, die Spielregeln des Welthandels, die Liberalisierung der Finanz- und Warenströme, das Wirken transnationaler Konzerne, die Ausbeutung der natürlichen Ressourcen und wachsende Ungleichheit von Einkommen und Vermögen haben maßgeblichen Einfluss auf die Gesundheit der Menschen und die Entstehung von Resistenzen.
Um die Antibiotika-Waffe nicht stumpf werden zu lassen und den Kampf gegen zunehmende Multiresistenzen zu gewinnen, sind Maßnahmen unumgänglich, die über das Gesundheitswesen und die Veterinärmedizin hinausgehen. „Zunehmende Antibiotikaresistenzen sind auch ein Problem der öffentlichen Gesundheit, das nach fachübergreifenden und globalen Antworten verlangt“, meint Dr. Peter Tinnemann, Leiter des Projektbereichs Globale Gesundheitswissenschaften an der Charité-Universitätsmedizin, „denn in der globalisierten Welt von heute lassen sich die anstehenden Probleme nicht allein auf nationaler Ebene lösen.“
Global Health ist gefragt, wenn die Erhaltung der öffentlichen Gesundheit weltumspannendes Handeln erfordert. Dieser Begriff geht über die geografische Bedeutung von „global“ hinaus, verbindet lokal und weltweit und beinhaltet ein politisches Konzept zur Durchsetzung des Rechts auf Gesundheit. Gesundheit für alle lässt sich ohne verantwortungsvolle Politik und Staatsführung und ohne Betrachtung der gesellschaftlichen Rahmenbedingungen, der tatsächlichen Machtverhältnisse und der weltweiten Ungleichheit nicht erreichen.
Neue Strategie zu globaler Gesundheit in Arbeit.
Die Bundesregierung arbeitet zurzeit an einer neuen Strategie zu globaler Gesundheit. Die erste Version stieß auf Kritik, weil sie zu stark naturwissenschaftlich-medizinische Ansätze betonte, auf Technologie-Export abzielte und den gesellschaftlichen Bedingungen von Gesundheit nur geringe Aufmerksamkeit schenkte.
Dabei konstatierte Rudolf Virchow schon 1848: „Medizin ist eine soziale Wissenschaft und Politik nichts anderes als Medizin im Großen.“ 100 Jahre später floss diese Erkenntnis in die Verfassung der WHO ein, die mittlerweile 70 Jahre alt, aber immer noch aktuell ist. Und wiederum drei Jahrzehnte später einigten sich die damals 123 WHO-Mitgliedsstaaten im kasachischen Alma Ata (heute Almaty) auf das Konzept der Basisgesundheitsversorgung (Primary Health Care) mit dem bis heute unerreichten Ziel „Gesundheit für alle“. Im Mittelpunkt standen dabei soziale Gerechtigkeit und demokratische Teilhabe.
170 Jahre nach Virchow, 70 Jahre nach Gründung der WHO und 40 Jahre nach Alma Ata bietet der heute weltweit erzeugte Reichtum eigentlich hervorragende Bedingungen, allen Menschen einen Lebensstandard zu ermöglichen, der persönliches Wohlbefinden und bestmögliche Gesundheit garantiert. Die Ressourcen sind vorhanden, das Menschenrecht auf Gesundheit überall auf der Welt zu gewährleisten. Dazu kann globale Gesundheitspolitik einen wichtigen Beitrag leisten, vorausgesetzt sie besinnt sich auf Rudolf Virchow und den Geist von Alma Ata.
So wenig, wie Gesundheit für alle ohne Beachtung aller gesundheitsrelevanten Politik- und Lebensbereiche wie Bildung, Arbeit, Wohnen, Ernährung, Verkehr, Umwelt, Sicherheit, Familie oder Freizeit erreichbar ist, lässt sich das Problem der weltweiten Antibiotikaresistenzen allein mit Medizintechnologie und Medikamenten lösen.
Glossar
Primary Health Care (PHC)
Grundlegende Gesundheitsversorgung auf Gemeindeebene auf Basis wissenschaftlich begründeter, praktikabler, sozial akzeptabler und nachhaltig finanzierbarer Interventionen. Das PHC-Konzept entstand 1978 auf der WHO-Konferenz in Alma-Ata. Als integraler Bestandteil des Gesundheitssystems umfasst PHC die Bekämpfung lokaler Gesundheitsprobleme, gesunde Ernährung, Trinkwasserversorgung und Hygiene, Mutter-Kind-Gesundheit einschließlich Familienplanung, Impfungen, Prävention endemischer Erkrankungen, Behandlung häufiger Erkrankungen und Verletzungen, Versorgung mit essenziellen Medikamenten sowie funktionierende Strukturen im Gesundheitssystem.
Public Health
Anwendungsorientiertes Fachgebiet, das sich mit der öffentlichen Gesundheit beziehungsweise der Gesundheit von Bevölkerungen oder Bevölkerungsgruppen befasst. Der interdisziplinäre Public-Health-Ansatz umfasst Epidemiologie, Sozialmedizin, Prävention, Gesundheitsförderung, Versorgungsforschung, Gesundheitssystemforschung, Gesundheitsökonomie und andere Teilgebiete. Die systemische Sichtweise und der umfassende Anspruch erfordern eine interdisziplinäre Arbeitsweise.
Global Health
Als Erweiterung von Public Health auf die internationale, globale Ebene betrachtet Global Health gesundheitsrelevante Themen als weltweite Herausforderung. Im Mittelpunkt stehen präventive und kurative multi- und interdisziplinäre Ansätze innerhalb und jenseits der Gesundheitswissenschaften. Die multilaterale, oftmals globale Zusammenarbeit hat die Angleichung der gesundheitlichen Lage der Länder und Menschen auf der Welt zum Ziel. Als politisches Konzept betrachtet Global Health Gesundheit als rechte-basiertes, universelles Gut und beschäftigt sich mit Governance-Strukturen, gesellschaftlicher Ungleichheit, Machtasymmetrien, ungleicher Ressourcenverteilung und gesellschaftlichen Determinanten von Gesundheit.
One Health
Gesundheitspolitischer Ansatz, der die systemischen Zusammenhänge von Mensch, Tier und Umwelt auf der einen und Gesundheit auf der anderen Seite berücksichtigt. Die aktuelle Antibiotika-Resistenzentwicklung erfordert eine inter- und transdisziplinäre Zusammenarbeit, Datenaustausch, Forschungs- und Ausbildungungsförderung, Governance und Unternehmensverantwortung.
Health in All
Der Ansatz berücksichtigt gesundheitliche Konsequenzen und Auswirkungen in allen Politikbereichen mit dem Ziel einer gesundheitsförderlichen Gesamtpolitik. Die Einbindung der unterschiedlichen Politikfelder in gesundheitsrelevante Themen erfordert kohärente politische Entscheidungen. Health in All bedeutet, sämtliche politischen Entscheidungen nach ihren gesundheitlichen und gesundheitspolitischen Auswirkungen zu bewerten.